ADP-核糖基化是一种重要的翻译后修饰,可调控多种关键的生物学过程。过去科学家们普遍认为只有蛋白质可作为ADP-核糖基化的靶标分子,但近期的研究表明,核酸也可作为ADP-核糖基化修饰的底物。其中,tRNA 2'-磷酸转移酶(TRPT1)不仅是tRNA剪接的必需因子,而且能够介导核酸底物末端的ADP-核糖基化修饰,因此引起了该领域专家学者的广泛关注。然而,TRPT1催化核酸ADP-核糖基化修饰的分子机制尚不明晰,且哺乳动物细胞中TRPT1的潜在生物学功能也是未知的。
2023年6月19日,河北大学生命科学学院DNA损伤修复研究团队刘秀华教授和吴琛教授共同通讯在国际权威期刊Nucleic Acids Research(IF=19.16, 5-year IF=17.21, JCR一区)在线发表题为“Structural and biochemical insights into the molecular mechanism of TRPT1 for nucleic acid ADP-ribosylation”的研究成果。该研究在分子水平揭示了TRPT1介导的核酸ADP-核糖基化修饰的催化反应机制,并初步探究了TRPT1在哺乳动物细胞中介导的核酸ADP-核糖基化修饰的潜在功能。这一发现对于深入理解ADP-核糖基化修饰的广泛作用以及TRPT1的生物学功能具有重要意义。
本研究使用X-射线晶体学方法解析了不同真核物种来源的TRPT1蛋白分别与其底物NAD+或产物ADPRp的复合物结构,结合生化及细胞实验的分析,得出以下结论:1)真核TRPT1具有保守的NAD+和核酸底物结合模式;2)当NAD+结合后,TRPT1内部关键的“SGR”基序通过诱导其所在的供体环(donor loop)发生明显的构象变化,从而促进ADP-核糖基化反应的发生;3)位于TRPT1RNA结合结构域上的关键氨基酸负责介导底物DNA或RNA的差异性结合,为结合不同类型的核酸底物提供了结构柔性;4)TRPT1使用不同的氨基酸介导核酸底物进行2'-PO4转移和ADP-核糖基化修饰。这项研究揭示了TRPT1作为ADP-核糖基转移酶的底物结合模式,阐释了TRPT1 2'-PO4转移和ADP-核糖基化修饰的分子机制。此外,本研究还发现人源TRPT1在宫颈癌细胞中异常高表达,在HeLa细胞中敲低TRPT1可以抑制细胞增殖,初步探究了人源TRPT1介导的核酸ADP-核糖基化修饰在哺乳动物细胞中的潜在功能及重要意义。
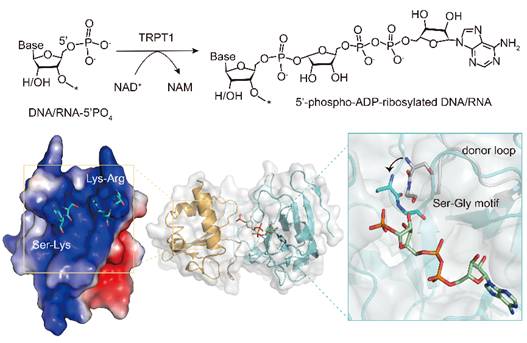
文章模式图(图源自Nucleic Acids Research )
河北大学生命科学学院博士研究生王佳旭和硕士研究生李思敏为本文的共同第一作者。河北大学生命科学学院闫珍珍研究员、硕士研究生李晓冰、弓婧婧参与了该研究。上海同步辐射光源周欢研究员为该研究相关数据收集提供了大力帮助和支持。河北大学生命科学学院DNA损伤修复研究团队刘秀华教授和吴琛教授为本文的共同通讯作者。河北大学为第一署名单位。该研究得到了国家自然科学基金委、河北省教育厅、河北省自然科学基金委员会和河北大学的经费支持。
《Nucleic Acids Research》由牛津大学(Oxford University Press)主办,是国际核酸研究领域影响力最高的期刊,在生物化学与分子生物学领域JCR排名前3%。
原文链接:https://doi.org/10.1093/nar/gkad525